随着液态活检的快速发展,采用体液对患者的分子特征进行分析成为可能,特别是基于循环肿瘤DNA(circulating tumor DNA,ctDNA)的高通量测序(next generation sequencing,NGS)技术,因其无创或微创、检测时间短、能够反映瘤内和转移灶异质性、可动态监测治疗疗效等优势而在临床得到越来越广泛的应用。
专家共识:ctDNA NGS检测的标准
ctDNA NGS检测的实验室要求
1、场地要求:严格遵循肿瘤二代测序实验室的总体设计与要求,强调“各区独立,注意风向,因地制宜,方便工作”原则。
2、试剂耗材要求:实验室应优先选择获得NMPA三类医疗器械证的检测试剂和配套耗材。若暂时没有,可用经过性能确认的临床实验室自建项目(laboratory developed test,LDT)试剂替代。所有 LDT 试剂耗材在用于检测前应进行性能确认,并形成试剂制备和使用的标准操作规范(standard operating procedure,SOP),报上级主管部门备案。
实验室体系构建
1、检测流程与质量控制:ctDNA NGS 检测的建立与优化涉及分析前、分析中以及分析后的三个阶段多个步骤,实验室质量管理需贯穿ctDNA NGS检测的整个流程。实验室应根据实际情况,建立室内质量控制,室间质量评价以及室间比对等SOP,并遵照执行。
2、试剂性能验证或性能确认:实验室使用已获批的高通量测序试剂开展临床检测服务前,必须对试剂进行性能验证。如果实验室改变已批准试剂指定的预期用途、试剂组分、操作流程,则按照LDT试剂要求进行管理,临床检测前需对检测系统(包含人、机、 料、法、环等)的分析性能进行确认。实验室应建立试剂性能确认检测操作全过程SOP,明确试剂的分析性能指标和检测局限性。分析性能评价指标至少应包括精密度、准确度、分析敏感性、分析特异性(包括干扰物质)、可报告范围。
样本收集、处理原则
ctDNA NGS检测实验室质量管理需贯穿全程,ctDNA 收集、样本处理和自动化过程应按照标准化和临床验证程序进行,防范因操作差异而引发的假阴性可能。样本采集建议采用含细胞稳定剂的抗凝管,尽快完成血浆分离,提取的 cfDNA 建议在24 h内进行后续检测,否则,置于-30 ℃至-15 ℃下储存并避免反复冻融。ctDNA NGS检测技术要点
专家共识:ctDNA NGS检测应根据项目需求选择技术路线,可依据检测基因数量及覆盖范围大小选择不同测序策略。在进行基于 ctDNA 的超高灵敏度突变检测时,建议使用分子标签技术和优化对应的生物信息分析设置,以降低由于测序平台随机误差导致的假阳性结果;建议通过建立测序噪音和克隆性造血背景库的方法降低克隆性造血及背景噪音带来的影响。
报告要求
专家共识:ctDNA NGS临床检测报告应包含受检者基本信息、样本信息、实验室信息、检测项目、检测结果及变异解读、检测方法的实验室内部验证结果、检测局限性及不确定性以及进一步检测的建议等内容。实验室应建立报告 SOP,建议根据国内外文献、共识指南、临床试验证据和实践对检出的肿瘤基因突变进行分类或分级报告。
菁良ctDNA标准品解决方案
高度模拟临床样本,包含热门基因突变位点
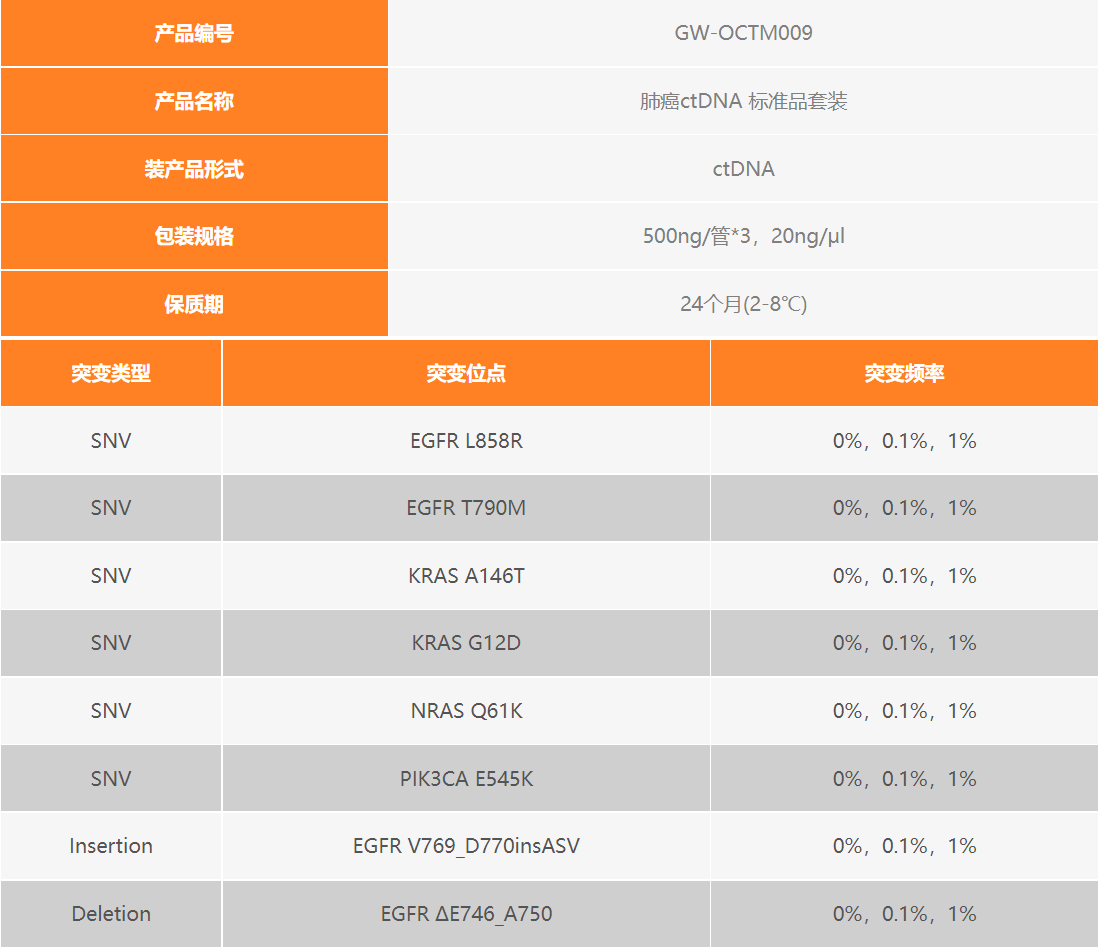
肺癌 ctDNA 标准品套装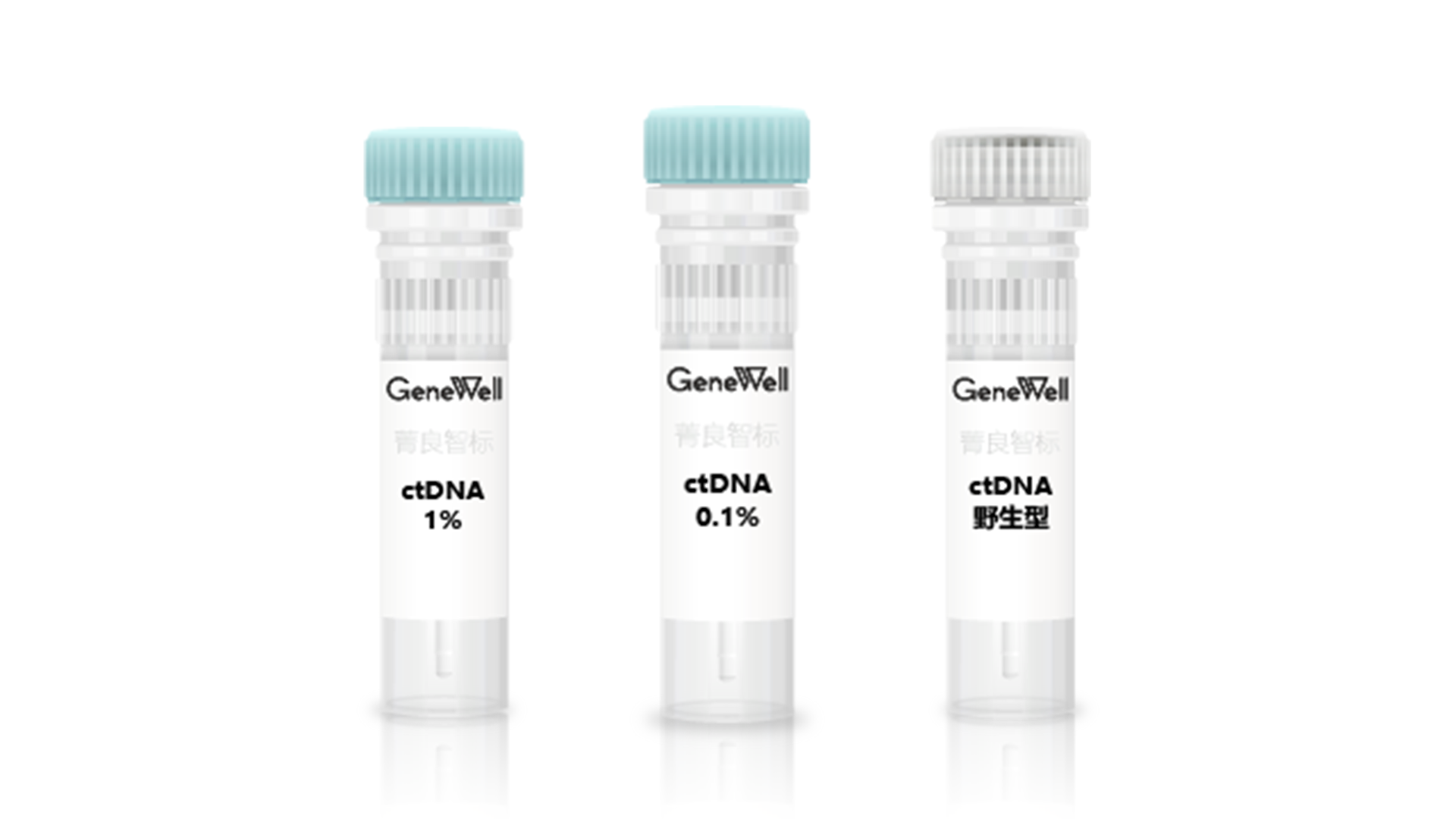
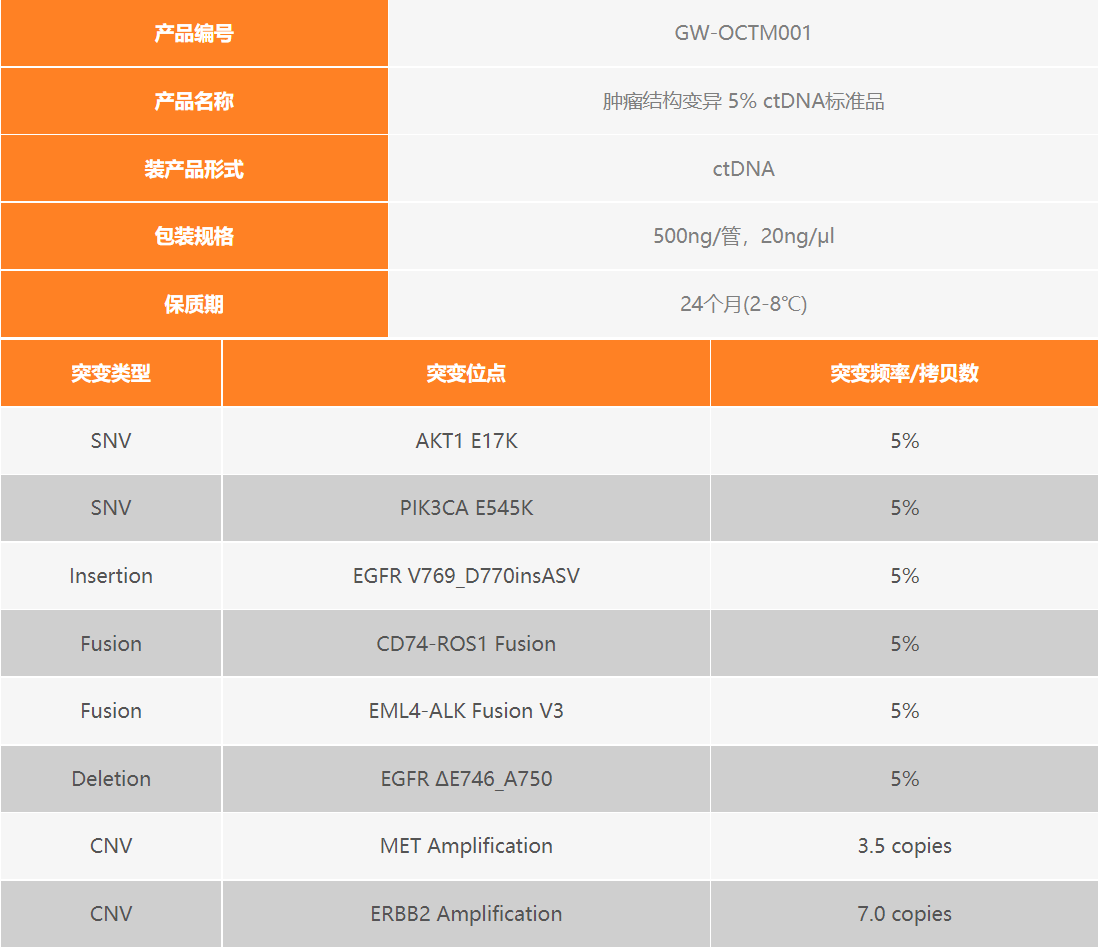
肿瘤结构变异 5% ctDNA标准品
肿瘤SNV 野生型 ctDNA 标准品

产品应用
肿瘤液体活检 ctDNA panel 验证
参考文献: [1]中国抗癌协会肿瘤标志专业委员会. ctDNA高通量测序临床实践专家共识(2022年版) [J]. 中国癌症防治杂志, 2022,14(3) :250-252
获取更多菁良基因质控品产品信息或订购,可联系我们
东区销售经理 13795223824
北区销售经理 15130655750
南区销售经理 15889963251
海外销售经理 15058190361
全国渠道总监 18501018000
技术支持热线 0755-25167057
技术支持:technical@gene-well.com



